Präliminäre Resultate der Kontrollversuche - Die Reaktion primärer humaner Epithelzellen auf stringente Virusamplifikations-Bedingungen widerlegen die Existenzbehauptungen aller Viren und von SARS-CoV-2
Dr. Stefan Lanka und Team
Einführung Videobesprechung der Kontrollen
Zusammenfassung
Exosomen sind kleine extrazelluläre Vesikel, die cargo-RNA, DNA und zelluläre Proteine enthalten. Sie werden von allen Zelltypen produziert, dienen der Zell-Zell Kommunikation und bieten vielversprechende therapeutische Möglichkeiten. Um die RNA-Spezies und extrazellulären Vesikel unter harschen, in der Virologie routinemäßig angewandten Protokollen zu untersuchen, wurden gesunde primäre menschliche Epithelzellen über drei Passagen mit Stressprotokollen für die Virus (Virion) Amplifikation kultiviert. Trotz fehlender Virusinokulation entwickelten die Zellen schwere zytopathische Effekte (CPE), die zu sichtbarer subtotaler Zerstörung und Plaquebildung im Zellrasen führten. Eine Blindinspektion von Zellen unter Kontroll- und Virusamplifikationsbedingungen ermöglichte die Identifizierung der unterschiedlichen Morphologien mit einer Trefferquote von 100 %. Die totale RNA aus Zellen und Zellkulturüberständen von drei biologischen und zwei technischen Replikaten pro Stressgruppe wurde zusammen mit der gesamt-RNA aus den gleichen, optimal kultivierten Zellen per next-generation sequencing aufgeschlüsselt. Sequenz- und extrazelluläre Vesikelanalysen sind im Gange
Einführung
Viren aus Isolaten, z.B. von Fledermäusen, werden in Zellkulturen unter harschen Kulturbedingungen vermehrt, indem ihnen durch Reduktion des fötalen Kälberserums (FCS) von 10 % auf 2 % oder 1 % in Dulbecco‘s Modified Eagle‘s Medium (DMEM) ein Grossteil der Nahrung entzogen wird, was den ATCC Empfehlungen entspricht. Der Nahrungsentzug wird außerdem routinemäßig mit hohen Konzentrationen von Dreifach-Antibiotika von Gibco (Penicillin/Streptomycin-Antibiotika mit Amphotericin B-Antimykotikum) und aufeinanderfolgendem „blind passaging“ von Zellkulturüberständen auf die nächste Zellkultur kombiniert.[1]
Morphologisch führt die Virionenamplifikation zu zytopathischen Effekten (CPE), die im Abrunden der Zellen, Ballonierung derselben und zellulärer Degeneration endet, was schließlich durch Plaquebildung in einer konfluenten Zellkultur sichtbar wird. Entsprechend können virale Partikel, die aus diesen Zellkulturüberständen angereichert werden, elektronenmikroskopisch abggebildet werden. Um die Hypothese auszuschließen, dass harsche Stressbedingungen ohne Virusinokulation möglicherweise zur Bildung von Exosomen[2] führen, die Virionen-ähnlich sind, haben wir gesunde primäre humane Epithelzellen routinemäßigen Virusamplifikationsprotokollen unterzogen. Anschließend isolierten wir Gesamt-RNA aus ausgehungerten oder Kontrollzellen und Überständen mit viralen RNA-Isolierungskits oder routinemäßiger TRIzol-Extraktion und unterzogen die RNA next-generation sequencing.
Resultate
Gesunde, primäre humane Epithelzellen wurden über vier Passagen (P3-P6) unter optimalen Kulturbedingungen in definiertem Epithel-Kontrollmedium mit 1x Triple-Antibiotika (CM) gezüchtet.
Nach der ersten Passage wurde der Zellpool in vier Gruppen aufgeteilt.
Nach 3 Tagen in CM wurden die Kulturen entweder in frisches CM (CM, Control 1), DMEM/GlutaMAX mit 10% FCS, 1x Triple-Antibiotika (Control 2) oder in ein Stress-Medium (Starvation 1 & 2) überführt.
Während der ersten Stressbehandlung enthielt das Stress-Medium DMEM, 1% FCS und 3x Triple-Antibiotika.
Die zweite und dritte Passage waren „blinde“ Passagen in denen 50% des Kulturüberstandes von der letzten Passage auf die nächste Passage in DMEM, 1% FCS und 3x Triple-Antibiotika übertragen wurde.
Die zweite Stress-Gruppe wurde zusätzlich bei jeder Passage mit totaler Hefe-RNA (yRNA) für eine Stunde vor der Zugabe des Stress-Mediums behandelt (Starvation 2).
Nach dem Transfer in DMEM mit 10 % FCS nahmen die Epithelzellen eine flachere Morphologie als im CM an und bildeten einen kontinuierlichen Zellrasen, was auf die hohen Kalziumkonzentrationen in DMEM zurückzuführen ist.
Ansonsten teilten sich die Zellen weiterhin normal (Abbildung 1A - siehe weiter unten).
Im Gegensatz dazu schrumpften die Zellrasen in den Stress-Medien zu kleinen Inseln mit reduziertem Wachstum und beginnender Zelldegeneration. Während der nächsten zwei Passagen zeigten die Zellen, die mit dem Überstand der gestressten Zellen der vorherigen Passage inkubiert wurden, zunehmende CPE mit zellfreien Bereichen, die an Virion-bedingte Plaques im Zellrasen erinnerten, und mehr tote Zellen schwammen im Überstand (Abbildung 1B - siehe weiter unten).
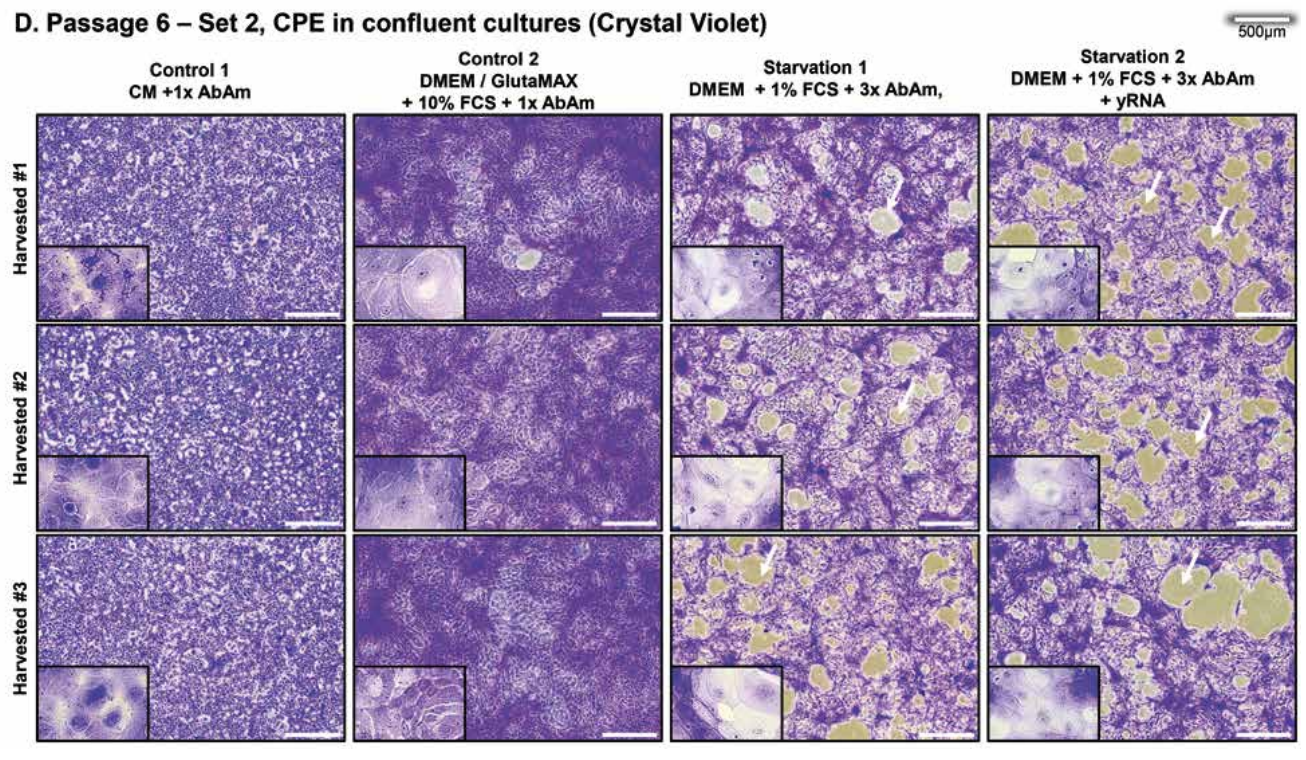
Konfluente Kulturen unter Stress (Abbildung 1C - siehe weiter unten), die mit Kristallviolett gefärbt wurden (Abbildung 1D - siehe weiter unten), bestätigen den ausgeprägten CPE.
Pyknotische Zellen mit kondensierten Kernen oder ballonierende Zellen waren überwiegend in der Starvation 1 Gruppe vorhanden und Bereiche mit totaler Zellzerstörung oder Plaques waren auch in der Starvation 1, aber vorwiegend in der Starvation 2 Gruppe zu beobachten.
Die Experimente wurden in drei biologischen Replikaten und zwei technischen Duplikaten durchgeführt. Alle Kulturen wurden blind inspiziert wobei die gestressten Kulturen leicht an drastischen Veränderungen der Morphologie zu erkennen waren.
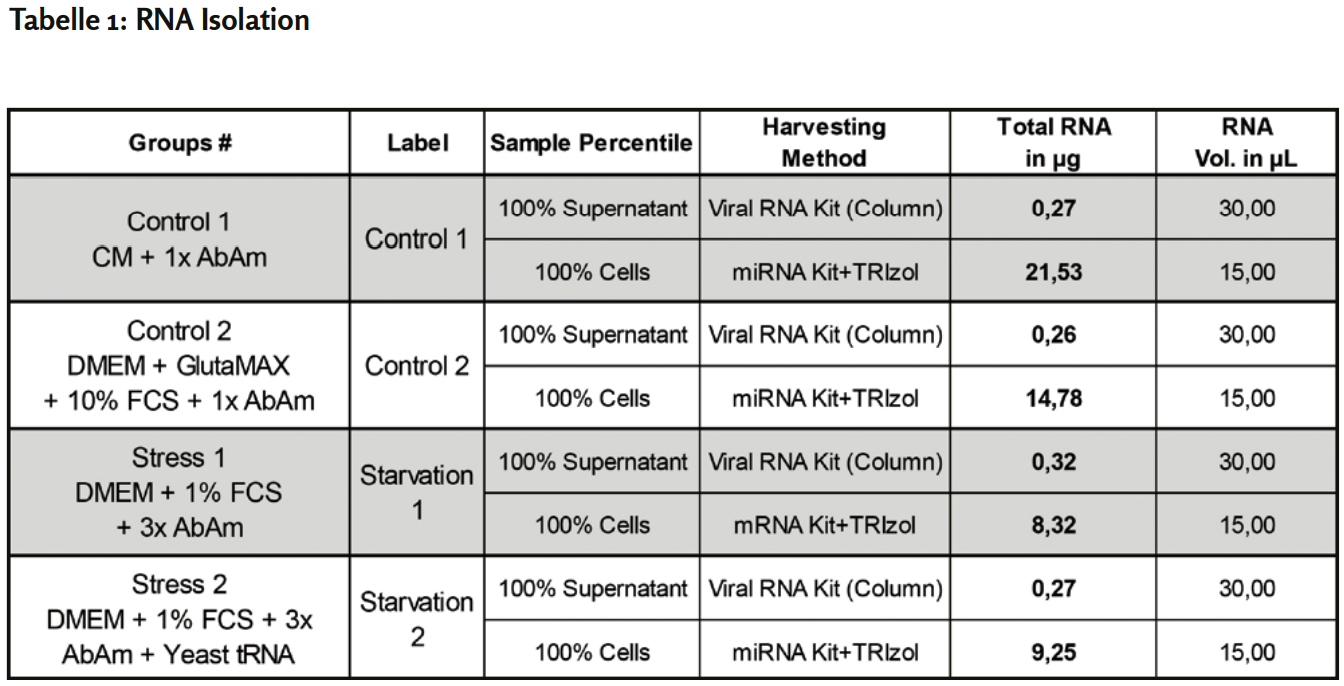
Nach drei Passagen wurde die RNA aus der Kontrolle 1 und den beiden gestressten Zellgruppen und Überständen mit viralen RNA-Kits oder TRIzol isoliert und next-generation sequencing unterzogen. Die isolierte Gesamt-RNA-Menge war in der Kontrollgruppe 1 am ergiebigsten (Tabelle 1 - siehe weiter unten) und hatte in allen Gruppen eine einwandfreie Qualität (Daten nicht gezeigt). Weitere Überstände wurden zur Analyse extrazellulärer Partikel weiterverwendet. Die Experimente sind in Bearbeitung.
Material und Methoden Zellkultur
Kommerzielle humane primäre Epithelzellen der Passage 3 wurden aufgetaut und mit 4‘000 Zellen/ cm2 in 75cm2-Flaschen zur Expansion bei 37°C mit 5% CO2 in definiertem Epithelialem Niedercalcium Medium (ohne FCS) und 1x Triple-Antibiotika (Gibco) (Kontrollmedium, CM) ausgesät.
Bei >80% Konfluenz wurden die Expansionszellen mit 5mL Accutase-Enzym bei 37°C für 10 Minuten abgelöst. Die Accutase wurde mit 10mL CM neutralisiert, die Zellen 5 Minuten bei 400G zentrifugiert, in 1mL CM resuspendiert, die lebenden Zellen mittels Trypanblau-Färbung im Countess II-Gerät (ThermoFisher) gezählt.
Die Zellen wurden für das Experiment oder parallele Expansionsrunden für nachfolgende Experimente ausgesägt. Für jedes Experiment wurden vier Gruppen gesunder primärer Epithelzellen aus demselben expandierten Pool in CM mit 4000 Zellen/cm2 in 25cm2 Kulturflaschen ausgesät und bis zu >50% Konfluenz kultiviert. Das Medium wurde dann durch vier experimentelle Bedingungen ersetzt; für Kontrollzellen durch frisches CM (Control 1) oder kommerzielles DMEM, ergänzt mit GlutaMAX, 10% hitze-inaktiviertes FCS und 1x Triple-Antibiotikum (Control 2).
Nahrung wurde entzogen, indem CM durch DMEM, mit 1% FCS und 3x Triple-Antibiotika ersetzt wurde, was im Wesentlichen den Protokollen der Virionenamplifikation1 entspricht (Starvation 1 & 2). Die gestresste Starvation Gruppe 2 wurde zusätzlich mit 10 µg Gesamt-Hefe-RNA (yRNA) pro Kulturflasche für 1h behandelt und vor dem Mediumwechsel Gruppe 1 & 2 gründlich mit phosphatgepufferter Koch-salzlösung (PBS) gewaschen. Anschließend wurden zwei «blind passages» durchgeführt, bei denen 50 % des Überstandes der Starvation Gruppen 1 und 2 in die nächste Zellkultur überführt wurde. Die Überstände wurden durch Zentrifugation bei 400G für 5 Minuten von toten Zellen gesäubert. Die Kontrollgruppen erhielten 100 % frisches Medium.
Die Experimente wurden dreimal in Duplikaten wiederholt. Die im ersten biologischen Replikat definierte Länge der Kultur unter Stress, wurden für alle Experimente konstant gehalten. Während der Stressperiode wurde kein Mediumwechsel durchgeführt.
P4: Medienwechsel bei Kontroll- und gestressten Zellen bei circa 50 Konfluenz; Kontrollzellen kultiviert bis >80% Konfluenz, gestresste Zellen kultiviert für 5 Tage nach Medienwechsel.
P5: Medienwechsel bei Kontroll- und gestressten Zellen >50 Konfluenz, Kontrollzellen kultiviert bis >80% Konfluenz, gestresste Zellen kultiviert für 8 Tage nach Medienwechsel.
P6/RNA Isolation: Medienwechsel bei Kontroll- und gestressten Zellen bei circa 50 Konfluenz; Kontrollzellen kultiviert bis >80% Konfluenz, gestresste Zellen kultiviert für 5 Tage nach Medienwechsel.
P6/Crystal violet: Medienwechsel bei Kontroll- und gestressten Zellen bei 100% Konfluenz; Stress Induktion für 3 Tage. Von allen Zellkulturen wurde täglich eine repräsentative Aufnahme bei Raumtemperatur mit einem Hellfeldmikroskop Nikon Eclipse TS100 mit einer Nikon 1J5 Kamera, einem Nikon FT1 Adapter und einem 4x Objektiv gemacht.
RNA-Extraktion aus Epithelzellkulturen und Überständen
Am Ende von Passage 6 wurde die Hälfte der gesamten zellulären RNA mit dem Promega miR-NA-Kit (Promega, Z6211), das für kleine und lange RNA-Proben empfohlen wird, gemäß dem Herstellerprotokoll isoliert. Die andere Hälfte der zellulären Gesamt-RNA wurde mit dem Standard-TRIzol-Protokoll isoliert. Die Gesamt-RNA aus dem Zellkulturüberstand wurde mit dem routinemäßig verwendeten Qiagen-Kit für virale RNA (Qiagen, 52904) gemäß dem Herstellerprotokoll isoliert.
Alle RNA-Proben wurden mit DNase behandelt. Die Gesamt-RNA-Konzentration sowie die Verhältnisse 260/280 und 260/230 wurden mit einem NanoDrop 2000 (ThermoFisher) bestimmt. Die RNA-Mengen waren am höchsten in den in CM kultivierten Proben und am niedrigsten in den gestressten Gruppen 1 und 2, während die Überstände sehr niedrige, aber ähnliche RNA-Mengen aufwiesen (Tabelle 1). 8,3 mg Gesamt-RNA von hoher Qualität, bewertet mit dem Bioanalyzer, aus der Kontrollgruppe 1 und den gestressten Gruppen 1 & 2 wurden mit «next generation RNA sequencing» sequenziert.
Kristallviolett-Färbung
Bei der letzten Passage wurde ein zweiter Satz von 25cm2-Kulturflaschen mit 8000 Zellen/cm2 (Satz 2) angesät, um zytopathische Effekte zu visualisieren. Bei 100 % Konfluenz wurden diese Zellen einer der vier Medienbedingungen ausgesetzt. Drei Tage nach der Exposition wurden die Zellen in 4% Paraformaldehyd für 30 Minuten bei Raumtemperatur fixiert und anschließend mit 1% Crystal Violet für weitere 30 Minuten bei Raumtemperatur angefärbt, bevor sie gründlich mit Leitungswasser bei Raumtemperatur gewaschen wurden. Zur Aufnahme der gefärbten Kulturen wurde das Hellfeldmikroskop Nikon Eclipse TS100 mit einer Nikon 1J5-Kamera, einem Nikon FT1-Adapter und einem 4- oder 20-fach-Objektiv verwendet.
Referenzen
[1] Ge, X. Y. et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature 503, 535-538, doi:10.1038/nature12711 (2013).
[2] Gurung, S., Perocheau, D., Touramanidou, L. & Baruteau, J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Commun Signal 19, 47, doi:10.1186/s12964-021-00730-1 (2021).
Abbildungen:
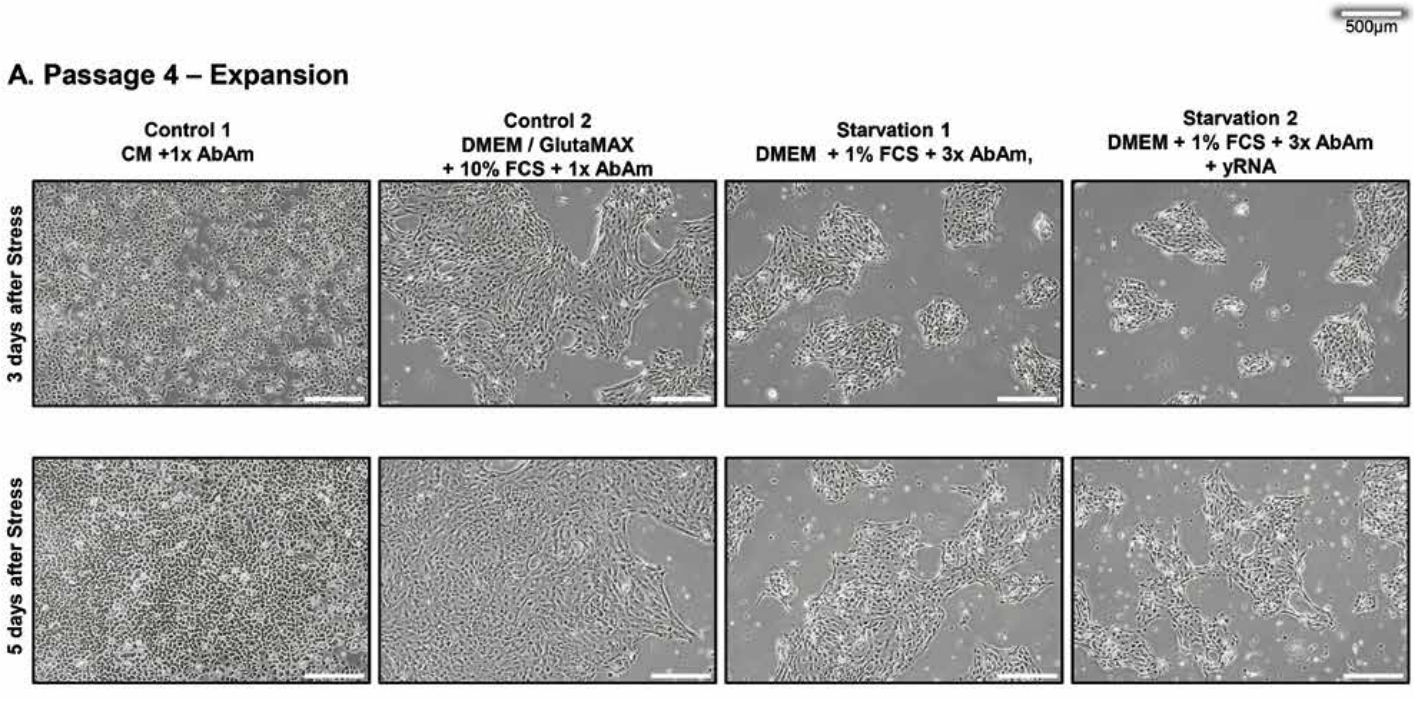
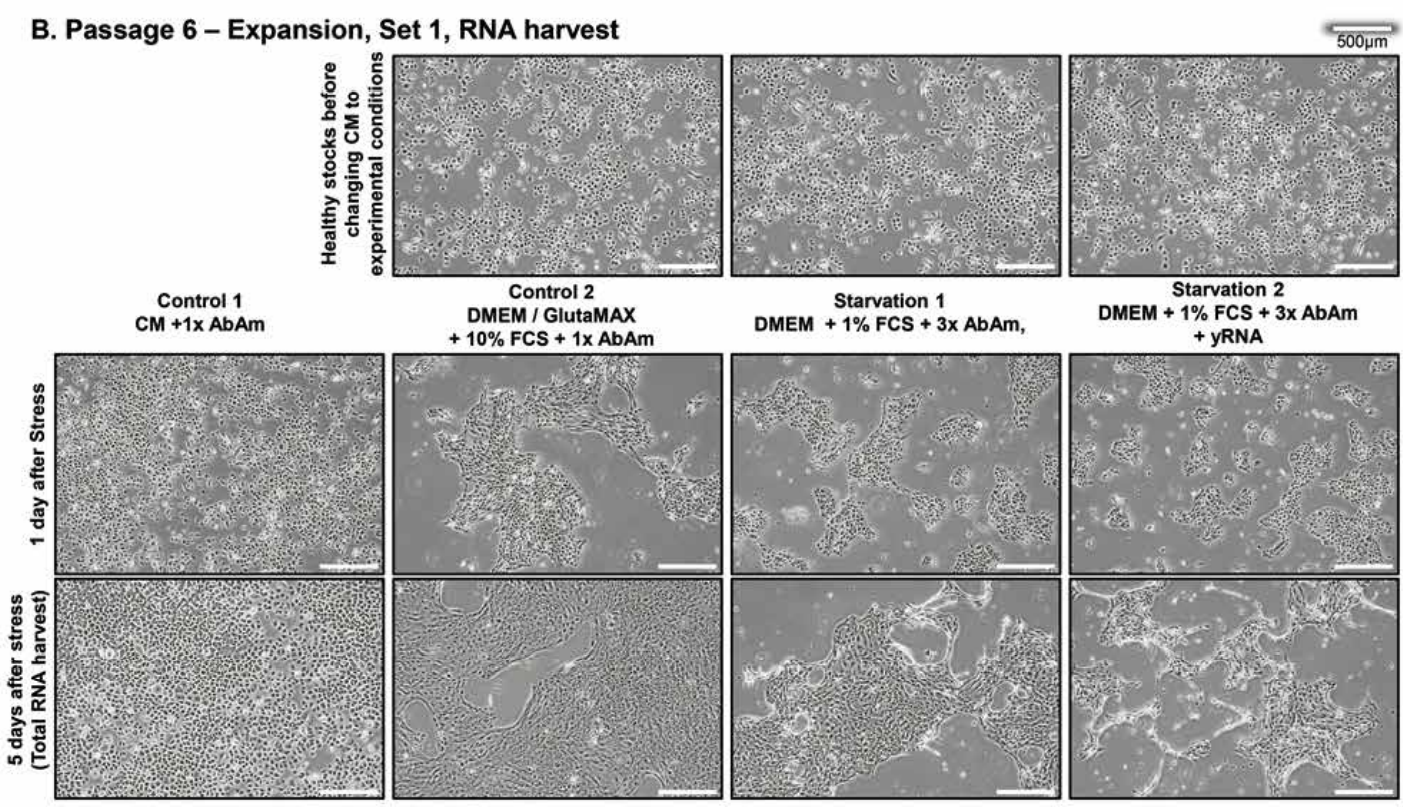


Abbildung 1. Stress von Epithelzellen. Repräsentative mikroskopische Aufnahmen der 4 experimentellen Gruppen von Epithelzellen bei Passage 4 und 6.
Von links nach rechts: gesunde Kontrollzellen mit 1x Triple-Antibiotika in Kontrollmedium (CM) oder DMEM/GlutaMAX mit 10% FCS; gestresste Zellen mit 3x Triple-Antibiotika und 1% FCS in DMEM.
Die Zellen im rechten Panel wurden vor dem Medienwechsel für 1h mit totaler Hefe-RNA (yRNA) behandelt.
(A), (B) Zellen in Expansion zum Zweck der RNA-Isolation. Es ist zu beachten, dass die CPE über die drei Passagen prominenter wird.
(B) Oberste Zeile: Zellen vor dem Mediumwechsel.
(C), (D) Konfluente Zellen zur Visualisierung von CPE; (C) Oberste Zeile: konfluente Zellen vor dem Mediumwechsel. (D) Zellkulturen aus 3 biologischen Replikaten, gefärbt mit Kristallviolett zum Zeitpunkt der Ernte. Zu beachten ist, dass die Zellen in den beiden linken Tafeln einen kontinuierlichen Zellrasen bilden während die Zellen in den beiden rechten Tafeln eine hohe Anzahl von Plaques (Pfeile) aufweisen, die mit signifikanten zytopathischen Effekten kompatibel sind, die von Tag 1 bis Tag 5 zunehmen. Mit Hefe-RNA behandelte Kulturen zeigen eine signifikant höhere Anzahl von größere Plaques.
Ausschnitte: 20-fache Vergrößerung; einige seltene pyknotische und ballonierende Zellen wurden in Kontrollkulturen beobachtet; ballonierende Zellen mit leerem Zytoplasma sind am häufigsten unter Stressbedingungen 1. Die Kulturen wurden von 2 Experimentatoren täglich blind mit einer Trefferquote von 100% inspiziert. Balken; 500 µm. Alle Kulturen: n=3 in Duplikaten.
NEXT LEVEL - Wissen neu gedacht fasse die Kontrollexperimente der Phase 1 – der sogenannte cytopathische Effekt – für sie zusammen:
- Der Effekt wird nicht – wie behauptet – durch ein "Virus" verursacht, sondern durch den Versuchsaufbau in vitro selbst.
- Die Kontrollergebnisse bestätigen, dass dieser Effekt nicht VIRENSPEZIFISCH ist und somit unmöglich als Nachweis für ein krankmachendes Virus behauptet werden kann und darf.
- Den zentralen Effekt (CPE), das Sterben von Gewebezellen im Reagenzglas, bekommen wir auf die gleiche Art und Weise hin, ohne jegliches infiziertes Material.
- Die morphologische Veränderung der Zellkultur wird durch Vergiften und Verhungern hervorgerufen.
- Diese Zellkultur (z. B. Vero E6) wird durch bestimmte Chemikalien und Antibiotika quasi vergiftet, gleichzeitig entzieht man ihr die Nährlösung, sie "verhungert" förmlich. Das "Vergiften" wird aus dem Glauben heraus durchgeführt, dass man sichergehen möchte, dass keine anderweitigen Ursachen für einen erwünschten Effekt als verantwortlich zu zeichnen sind. Die Nährlösung wird den Zellen deswegen entzogen, weil man damit diese hungrig machen möchte, so dass sie die angeblichen "Viren" besser aufnehmen. Leider sind genau diese beiden Vorkehrungen – Vergiften und Verhungern – ursächlich dafür anzusehen, dass ein Effekt eintritt, der auch mit einem indirekten Nachweis für das Isolieren, Kultivieren und die Zerstörungskraft eines krankmachenden Virus gleichgesetzt wird. Ein fataler IRRTUM!
- Dieser Effekt kann sogar noch massiv verstärkt werden, wenn man z. B., wie es Dr. Stefan Lanka im Labor hat durchführen lassen,
sogenannte standardisierte Hefebotensubstanz (die RNA aus Hefen) hinzugibt. - Alle durchgeführten Kontrollergebnisse bestätigten, dass als Ursache für den sogenannten cytopathischen Effekt kein Virus zu Grunde liegt, sondern Faktoren wie der Versuchsaufbau ursächlich sind.
- Diese Kontrollversuche wurden von allen Virologen weltweit bisher nicht durchgeführt, oder dokumentiert, bis heute werden diese ignoriert.
- Die Virologen benutzen das Wort „Isolation“ nicht im eigentlichen Sinne des Wortes Isolation. Sie verstehen unter „Isolation“ die Erzeugung des cytopathischen Effektes im Labor, den sie gleichzeitig als
a) Infektion
b) Beweis für die Anwesenheit eines Virus
c) Beweis für dessen Vermehrung
d) Beweis für die Zerstörungskraft des angenommenen Virus deuten. - Die Virologen nennen diese absterbenden Gewebe/Zellen ein Isolat, welches sie dann am Markt für ca. 2.000 Euro anbieten und behaupten fälschlicherweise, dass sich darin ein Virus befinde. Ergänzend behaupten die Virologen, dass sie daraus einen Impfstoff produzieren können.
NEXT LEVEL wird auf unterschiedlichen Social-Media Plattformen präsent sein, dazu gehören zu Beginn
Telegram,
Youtube,
Odysee,
Twitter und
Facebook.
© NEXT LEVEL – Wissen neu gedacht 2022
Das Magazin und alle Inhalte sind urheberrechtlich geschützt. Alle Rechte liegen bei
NEXT LEVEL- Wissen neu gedacht. Das Magazin, oder Teile davon, dürfen nicht vervielfältigt werden.
Die Informationen im Magazin von NEXT LEVEL – Wissen neu gedacht sind unsere persönliche Meinung und Ergebnis unserer persönlichen Recherche. Sie unterstreichen unser Recht auf freie Meinungsäußerung. Unser Magazin erhebt weder den Anspruch auf Vollständigkeit noch kann die Aktualität, Richtigkeit und Ausgewogenheit der dargebotenen Information garantiert werden. In unserem Magazin berichten wir über Zusammenfassungen von Literaturrecherchen, Zitaten und Erfahrungen von Privatpersonen. Fehler und Irrtümer sind vorbehalten.
NEXT LEVEL – Wissen neu gedacht
haftet nicht für Informationen Dritter oder für Informationen
auf verlinkten Seiten.
© NEXT LEVEL – Wissen neu gedacht 2022

